Perioperativer Umgang mit der Therapie von Patienten mit entzündlich-rheumatischen Erkrankungen
Aktualisierte Empfehlungen der DGRh
Erstveröffentlichung Januar 2022 / zuletzt überprüft August 2024
Zusammenfassung
Hintergrund. Vor operativen Eingriffen stellt sich Ärzten und Patienten mit entzündlich-rheumatischen Erkrankungen weiterhin die Frage nach einer Unterbrechung oder Fortsetzung der entzündungshemmenden Medikation. Die Deutsche Gesellschaft für Rheumatologie hat hierfür ihre Empfehlungen von 2014 aktualisiert.
Methoden. Nach einer systematischen Literaturrecherche mit Einschluss von Publikationen bis zum 31.08.2021 wurden die Empfehlungen zum Umgang mit Glukokortikoiden, konventionell synthetischen disease-modifying antirheumatic drugs (csDMARDs) und Biologika (bDMARDs) überarbeitet und Empfehlungen zu neueren Substanzen und targeted-synthetic (ts)DMARDs ergänzt.
Ergebnisse. Die Glukokortikoid-Dosis sollte 2-3 Monate vor elektiven Eingriffen so niedrig wie möglich reduziert (in jedem Fall <10mg/Tag), 1-2 Wochen vor und am OP Tag jedoch stabil gehalten werden. csDMARDs können in vielen Fällen fortgeführt werden, Ausnahmen sind eine Reduktion hoher Methotrexat Dosierungen auf ≤15mg/Woche und Auswaschen des Leflunomid bei hohem Infektionsrisiko. Azathioprin, Mycophenolat und Ciclosporin sollten 1-2 Tage vor der OP pausiert werden. Unter bDMARDs können Operationen zum Ende des jeweiligen Therapieintervalls geplant werden. JAK-Inhibitoren sollten bei größeren Eingriffen für 3-4 Tage pausiert werden. Apremilast kann fortgeführt werden. Bei notwendiger Unterbrechung gilt für alle Substanzen, die Therapie in Abhängigkeit der Wundheilung baldmöglichst wieder zu beginnen.
Schlussfolgerungen. Ob bDMARDs das Infektionsrisiko perioperativ erhöhen und welche Rolle die Absetzzeit dabei spielt, bleibt bei gegenwärtiger Evidenz noch unklar. Um das Risiko eines Krankheitsschubs unter längerer Therapiepause zu minimieren, wurde in den aktualisierten Empfehlungen die perioperative Pausierung von bDMARDs von mindestens zwei Halbwertszeiten auf ein Therapieintervall reduziert.
Schlüsselwörter perioperativ, OP, entzündlich-rheumatische Erkrankungen, Glukokortikoide, DMARDs, Biologika
Abstract
Background. Prior to surgical interventions, physicians and patients with inflammatory rheumatic diseases remain concerned about interrupting or continuing anti-inflammatory medication. The German Society for Rheumatology has updated its recommendations for this.
Methods. After a systematic literature search including publications until 08/31/2021, the recommendations on the perioperative management of glucocorticoids, conventional synthetic disease-modifying antirheumatic drugs (csDMARDs) and biologics (bDMARDs) were revised and recommendations on newer drugs and targeted-synthetic (ts)DMARDs were added.
Results. The glucocorticoid dose should be reduced as low as possible 2-3 months before elective surgery (in any case <10mg/day), but kept stable 1-2 weeks before and on the day of surgery. csDMARDs can be continued in many cases, exceptions being reduction of high methotrexate doses to ≤15mg/week and wash-out of leflunomide if infection risk is high. Azathioprine, mycophenolate and ciclosporin should be paused 1-2 days prior to surgery. Under bDMARDs, surgery can be scheduled at the end of the treatment interval. JAK inhibitors should be paused for 3-4 days. Apremilast can be continued. If interruption is necessary, therapy should be restarted as soon as possible for all substances, depending on wound healing.
Conclusions. Whether bDMARDs increase the risk of infection perioperatively and the benefits and risks of discontinuation remains unclear. To minimize the risk of a disease relapse under longer therapy pause, the perioperative interruption of bDMARDs was reduced from at least two half-lives to one therapy interval in the updated recommendations.
Key Words: perioperative, inflammatory rheumatic diseases, glucocorticoids, DMARDs, biologic therapy
INHALTSVERZEICHNIS
1. Einleitung
2. Allgemeine Empfehlung
3. Übergeordnete Empfehlungen
4. Empfehlungen zu den einzelnen Substanzen
5. Diskussion
6. Literatur
Der perioperative Umgang bezüglich der Therapie von Patienten mit entzündlich-rheumatischen Erkrankungen bleibt aufgrund der Vielzahl der heute eingesetzten immunsuppressiven und immunmodulierenden Therapien eine komplexe Herausforderung. In den letzten 20 Jahren hat sich die Patientenzahl mit operativen Gelenkeingriffen bei rheumatoider Arthritis zwar mehr als halbiert, [1]. dennoch gibt es weiterhin notwendige operative orthopädische und andere Eingriffe, welche die Frage nach der perioperativen Fortführung oder Pausierung der rheumatologischen Therapie zu einer interdisziplinär relevanten Thematik im rheumatologischen und rheuma-orthopädischen bzw. chirurgischen Alltag machen.
Die Deutsche Gesellschaft für Rheumatologie (DGRh) hat im Jahr 2014 erstmals Empfehlungen zur perioperativen Vorgehensweise bei Patienten mit entzündlich-rheumatischen Erkrankungen formuliert [2]. Es wurden Empfehlungen bezüglich einer perioperativen Unterbrechung oder Fortführung der einzelnen konventionell synthetischen krankheitsmodifizierenden antirheumatischen Medikamente (engl. disease-modifying antirheumatic drugs, csDMARDs) und biologischen DMARDs (bDMARDs) konsentiert. Seither wurden mit den zielgerichteten DMARDs (engl. targeted synthetic DMARDs, tsDMARDs), den JAK-Inhibitoren und dem PDE4 Hemmer Apremilast sowie einigen Interleukin-Blockern neue Substanzen für die Behandlung entzündlich-rheumatischer Erkrankungen zugelassen und angewendet, für die es bis dato noch keine Empfehlungen gab. Im Rahmen der zertifizierten Fortbildung der Zeitschrift für Rheumatologie wurden diese 2017 bereits um neue Literatur angepasst [3]. International gibt es Empfehlungen des American College of Rheumatology (ACR) von 2017, die gemeinsam mit der „American Association of Hip and Knee Surgeons“ Richtlinien für das perioperative Management bei Hüft- und Kniegelenksersatz bei Patienten mit rheumatoider Arthritis, axialer Spondyloarthritis, Psoriasisarthritis und systemischem Lupus erythematodes entwickelt hatten [4]. Diese wurden 2020 im Rahmen einer Übersichtsarbeit aktualisiert [5]. Die European League Against Rheumatism (EULAR) hat bislang keine Empfehlungen publiziert. Daher beauftragte der Vorstand der DGRh die Kommission Pharmakotherapie im Sommer 2020, die nationalen Empfehlungen zur perioperativen DMARD-Therapie zu aktualisieren.
Methodik
Es wurde eine systematische Literatursuche für den Zeitraum vom 01.05.2013 (Ende der SLR der bisherigen Empfehlungen) bis zum 31.08.2021 durchgeführt. Einschlusskriterien sind in Abbildung 1 angeführt. Folgende Substanzen wurden berücksichtigt: csDMARDs (Methotrexat, Leflunomid, Sulfasalazin, Hydroxychloroquin, Azathioprin, Ciclosprin A, Mycophenolat, Cyclophosphamid), TNF-Inhibitoren (Adalimumab, Certolizumab, Etanercept, Golimumab, Infliximab), der T-Zell-Kostimulationsblocker Abatacept, der B-Zell Depletor Rituximab, IL-1-Inhibitoren Anakinra, und Canakinumab, IL-6-Rezeptor-Inhibitoren Sarilumab und Tocilizumab, IL-17 Inhibitoren Ixekizumab und Secukinumab, IL-23 (und IL-12/23) Inhibitoren Guselkumab und Ustekinumab, der BLyS-Inhibitor Belimumab, JAK-Inhibitoren (Baricitinib, Filgotinib, Tofacitinib, Upadacitinib) und der PDE4-Inhibitor Apremilast. Es wurden 3 Metaanalysen, 19 Kohortenstudien und 5 Empfehlungen eingeschlossen. Die identifizierten Publikationen wurden den Substanzen zugeordnet und mit den bisherigen deutschen und internationalen Empfehlungen abgeglichen. Die bisherigen deutschen und die ACR Empfehlungen wurden als Referenzempfehlungen ausgewählt und hinsichtlich Kongruenz überprüft. Aus diesen und der neu hinzugekommenen Literatur wurden die Empfehlungen aktualisiert und im Konsens formuliert. Die Kommissionsmitglieder bewerteten jede Kernempfehlung mit ihrer Zustimmung oder Ablehnung und dem Grad der Zustimmung auf einer Numerischen Rating Skala (Grad 0=stimme nicht zu, Grad 10=stimme voll zu). Die Empfehlungen wurden vom Vorstand der DGRh begutachtet und verabschiedet.
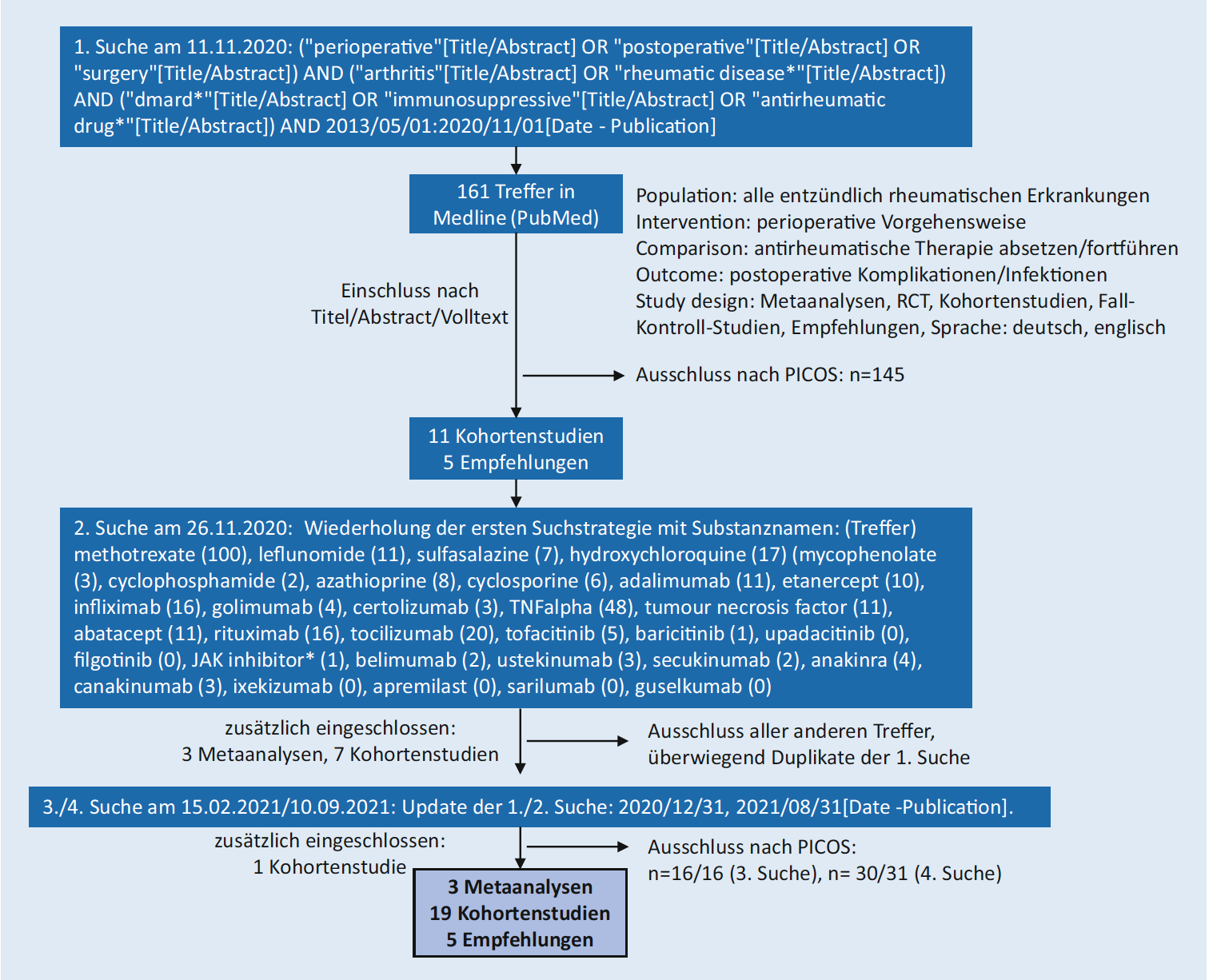
Abbildung 1: Systematische Literatursuche zur perioperativen Therapie bei entzündlich-rheumatischen Erkrankungen

Patienten mit entzündlich-rheumatischen Erkrankungen haben je nach Therapie und Grunderkrankung ein erhöhtes Risiko für perioperative Infektionen [6]. Das individuelle Risiko für Komplikationen hängt wesentlich von dem Zustand der rheumatologischen Grunderkrankung ab (Tab.1). Hohe Krankheitsaktivität, fortgeschrittene Krankheitsdauer und eine schwerer verlaufende Erkrankung tragen zu einem höheren Risiko bei, während eine gut kontrollierte Erkrankung per se ein niedrigeres Infektionsrisiko birgt und zusätzlich mit einem geringeren Glukokortikoid-Bedarf einhergeht. Bei elektiven Eingriffen sollte die Grunderkrankung im Vorfeld bestmöglich eingestellt werden, auch bei Bedarf unter Verwendung von bDMARDs. Rauchen, Alkoholkonsum und Mangelernährung erhöhen das Risiko für Komplikationen, dieses sollte im Vorfeld adressiert werden. Komorbiditäten, insbesondere vorausgegangene Infektionen, Adipositas, Diabetes mellitus, Anämie und chronische Lungenerkrankungen sind weitere Risikofaktoren, die bei einem elektiven Eingriff durch eine vorherige Optimierung (z.B. BMI <40kg/m2, HbA1c < 7%, Transfusion) modifiziert werden können [6]. Eine bei rheumatischen Erkrankungen häufig vorkommende begleitende Osteoporose erhöht das Risiko für lagerungsbedingte Frakturen und kann die Stabilität von Osteosynthesen vermindern [7]. Die präoperative Behandlung von Hautläsionen und Hautkontaminationen mit Staphylokokken oder Streptokokken kann das Risiko der Keimübertragung reduzieren [6]. Vorausgegangene periprothetische Infektionen sind ein hoher Risikofaktor für weitere Protheseninfektionen. Bei Patienten, die eine infizierte Prothese nach Knie- bzw. Hüftgelenksersatz hatten, war das Risiko für eine erneute Infektion bei einer weiteren Endoprothese an einem anderen Gelenk in einer Fall-Kontroll Studie dreifach erhöht [8]. Bei oralchirurgischen Eingriffen ist eine bakterielle Kontamination zu erwarten, so dass eine Antibiotikaprophylaxe empfohlen wird [9]. Hier ist der Einfluss der immunsuppressiven Wirkung der antirheumatischen Therapie auf die Infektionsgefahr und Wundheilungsstörungen höher einzustufen als bei aseptischen Eingriffen, so dass eine Pausierung der Medikation eher in Betracht gezogen wird [10].
Die Arbeitsgruppe stimmte in den übergeordneten Empfehlungen vollständig überein, dass die Entscheidung, ob und wie lange die antirheumatische Therapie bei einem elektiven Eingriff pausiert werden soll, in Abhängigkeit vom individuellen Infektionsrisiko und dem Risiko eines Krankheitsschubs getroffen werden muss. Dringende bzw. notfallmäßige Operationen sollten unabhängig von der eingenommenen DMARD-Therapie zeitnah bzw. sofort durchgeführt werden. Um das Risiko eines Schubs zu minimieren, soll eine Pausierung der antirheumatischen-Therapie so kurz wie möglich gehalten werden und die Therapie bei regelrechten Wundverhältnissen baldmöglichst wieder begonnen werden. (Tab.2). Bei hoher Krankheitsaktivität sollten elektive Eingriffe nicht erfolgen, sondern erst eine Stabilisierung der rheumatischen Erkrankung erreicht werden.
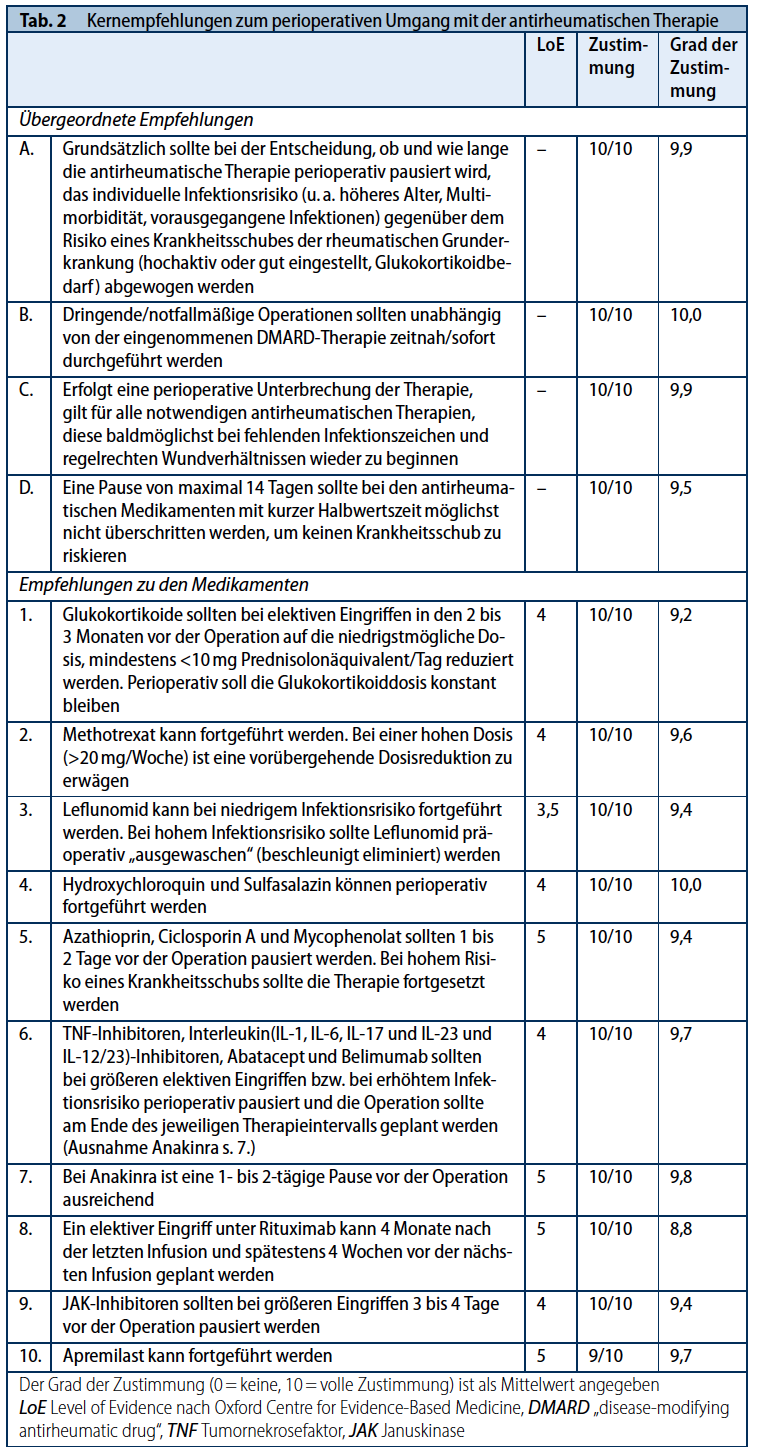
Tabelle 2: Kernempfehlungen zum perioperativen Umgang mit der antirheumatischen Therapie
4. EMPFEHLUNG ZU DEN EINZELNEN SUBSTANZEN
Die vorliegende Evidenz ist für alle Empfehlungen als schwach einzustufen und beruht überwiegend auf retrospektiven Studien bzw. bei gänzlich fehlenden Daten auf Expertenmeinung.
Glukokortikoide
Neue größere Studien [11-14] bestätigen bereits früheren Empfehlungen zugrundeliegende Daten [15,16], welche auf ein dosisabhängig erhöhtes Risiko für perioperative Komplikationen, vor allem von Infektionen, unter Glukokortikoiden (GC) hinweisen: eine auf Krankenkassendaten basierende retrospektive Studie mit 10.923 RA-Patienten nach elektivem Knie- oder Hüftgelenkersatzes ergab, dass das Risiko für zur Hospitalisierung führenden Infektionen innerhalb von 30 Tagen postoperativ signifikant höher unter 5-10 mg Prednisonäquivalent/Tag (OR 1,32) und unter >10 mg/Tag (OR 2,10) war im Vergleich zu Patienten ohne GC. Das Risiko für Prothesen-Gelenkinfektionen innerhalb eines Jahres war unter 5-10mg/Tag numerisch (HR 1,36) und unter >10mg/Tag signifikant höher (HR 1,86) [11]. Ergänzende Daten aus einer methodisch vergleichbaren Studie mit 10.483 RA-Patienten, welche sich anderen großen Operationen unterzogen (Hüftfraktur-Osteosynthese, Bauch-/Becken oder Herz-Operation), zeigen signifikant erhöhte Risiken bezüglich adjustierter 90 Tage-Mortalität und 30 Tage-Re-Hospitalisierung bei GC 5-10 mg/Tag (OR 1,41 und OR 1,26) sowie bei >10 mg/Tag (OR 1,64 und OR 1,60) [12]. In einer dänischen registerbasierten Kohortenstudie wurden GC zudem (neben erhöhter Krankheitsaktivität) als Risikofaktor für Mortalität nach Knie-/ Hüftgelenkersatz identifiziert (HR=2,87) [13]. In einer weiteren retrospektiven Analyse mit 14.774 Patienten unter Langzeit-GC-therapie aufgrund verschiedener chronischer Erkrankungen fanden sich im Vergleich zu Patienten ohne GC gemäß einer univariaten Analyse signifikant mehr perioperative Komplikationen, einschließlich Wundinfektionen, tiefer OP-Infektionen, Wunddehiszenz, Pneumonie, Harnwegsinfektionen und Re-Hospitalisierung [14].
Zusammenfassend zeigen die Studien ein dosisabhängig zunehmendes (<5 mg meist numerisch, 5-10 mg und > 10 mg signifikant vs. ohne GC) postoperatives Risiko mit konsistent hochsignifikant erhöhtem Risiko ab einer Dosis von >10mg Prednisolonäquivalent/Tag (während der präoperativen Phase, in der Regel 3 Monate) für postoperative Infektionen und weiteren Komplikationen wie Re-Hospitalisierung bzw. Mortalität. Daher sollte die GC-Dosis in den ca. 3 Monaten vor elektiven Operationen, sofern es die Therapie der entzündlichen Erkrankung erlaubt, so niedrig wie möglich sein, zumindest weniger als 10 mg betragen. Eine Minimierung der GC-Dosis in den Monaten vor einem chirurgischen Eingriff kann die Ergebnisse verbessern und ein Aufschub des chirurgischen Eingriffs kann in bestimmten Situationen angebracht sein, insbesondere bei Patienten, die hohe GC-Dosen erhalten. Bei elektiven lange vorher bekannten Operation ist angesichts des geringeren Risikos für csDMARDs und bDMARDs im Vergleich zu GC > 10 mg eine leitliniengerechte Anpassung der Therapie zur GC-Einsparung im Vorfeld der OP wünschenswert.
Eine Empfehlung zu Reduktion der GC-Dosis wenige Tage vor Operationen unter 10 mg Prednisolonäquivalent/Tag oder geringer kann daraus jedoch nicht abgeleitet werden, da eine Verringerung des Risikos durch kurzfristige eine präoperative Dosisreduzierung bisher nicht nachgewiesen wurde. Daraus folgend sollte die GC-Dosis, welche die Patienten für ihre entzündlich-rheumatische Erkrankung erhalten, kurz vor Operationen (ca. 1-2 Wochen) konstant beibehalten werden.
Eine weitere Besorgnis bezüglich kurzfristiger präoperativer GC-Dosisreduktion, welche auch in früheren Empfehlungen thematisiert wurde [4,2,3], ist eine perioperative hämodynamische Instabilität/ Hypotonie aufgrund einer Nebenniereninsuffizienz bei physiologisch höherem Cortisol-Bedarf durch den OP-bedingten Stress. Diesbezüglich ist weiterhin davon auszugehen, dass eine erhöhte supraphysiologische perioperative Dosis („Stressprophylaxe“ z.B. mit Hydrokortison) bei GC-Dauertherapie bis 20 mg/Tag nicht erforderlich und zudem die Messung von Cortisol-Spiegeln nicht hilfreich ist [17]. Patienten sollten daher am Tag der Operation nur die übliche GC-Tagesdosis erhalten.
Methotrexat
Zu Methotrexat (MTX) liegen Ergebnisse von zwei randomisiert kontrollierten Studien vor, die kein erhöhtes (und sogar ein erniedrigtes) Infektionsrisiko unter MTX-Therapie bei Patienten mit RA, bei denen ein orthopädischer Gelenkseingriff durchgeführt wurde, zeigten [18,19]. Auch bei Patienten mit chronisch-entzündlichen Darmerkrankungen, die sich einer abdominalen Operation unterzogen, wurde kein erhöhtes Risiko für postoperative Komplikationen (einschließlich Infektionen und Wundheilungsstörungen) unter bestehender präoperativem MTX-Therapie gezeigt [20]. Somit kann die Therapie mit MTX perioperativ fortgeführt werden. Dadurch verringert sich auch das Risiko einer Verschlechterung / eines Schubes der Grunderkrankung [18]. Gleiches empfiehlt die amerikanische Leitlinie zum perioperativen Einsatz von Medikamenten bei Patienten mit rheumatologischen Erkrankungen [4]. Es muss allerdings erwähnt werden, dass die hohen MTX-Dosen (>20 mg/Woche) nicht explizit untersucht wurden, weshalb eine vorübergehende Reduktion der Dosis auf ≤15 mg/Woche erwogen werden sollte. Eine Verschiebung der wöchentlichen Injektion kann bei Bedenken wegen möglicher Interaktionen bzw. wegen der additiven Hepatotoxitität bei perioperativ einzusetzenden Medikamenten in Betracht gezogen werden.
Leflunomid
Für Leflunomid ist die Datenlage nicht eindeutig. Während in einer Studie Leflunomid mit keinem erhöhten Risiko für Infektionen nach Totalendoprothesen bei Patienten mit rheumatoider Arthritis assoziiert war [21], wurde in einer anderen Studien ein erhöhtes Risiko für Wundheilungsstörungen gezeigt [22]. Es liegen nach wie vor keine randomisierten kontrollierten Studien vor, weshalb wir bei dem pragmatischen Vorgehen der vorherigen nationalen Leitlinien [2] bleiben: Fortführung von Leflunomid bei niedrigem Infektionsrisiko und kleineren Eingriffen; Auswaschen im Sinne einer beschleunigten Elimination (8 g Cholestyramin 3× täglich oder 50 g Aktivkohlepulver 4× täglich über 5 Tage) bei hohem Infektionsrisiko bzw. bei größeren Eingriffen. Nach Abschluss der Wundheilung kann die Therapie wieder begonnen werden. Wegen einer langen Halbwertszeit von bis zu 4 Wochen und Persistieren des aktiven Metaboliten Teriflunomid durch enterohepatische Rezirkulation bis zu 2 Jahre ist ein einfaches Absetzen von Leflunomid unmittelbar vor dem geplanten Eingriff ohne Auswaschverfahren nicht sinnvoll.
Sulfasalazin
In einer retrospektiven Kohortenstudie mit 768 Patienten und 1219 elektiven Eingriffen war Sulfasalazin mit keinem erhöhten, sondern einem verringerten Risiko der Komplikationen einschließlich der Infektionen assoziiert [23]. Es ist anzunehmen, dass Sulfasalazin keine nennenswerte immunsuppressive Wirkung besitzt und damit das Infektionsrisiko nicht erhöht. Demensprechend halten auch die amerikanischen Empfehlungen eine perioperative Unterbrechung für nicht notwendig [4]. Wegen der relativ kurzen Halbwertszeit (6-8 Stunden) könnte Sulfasalazin bei begründeten Bedenken hinsichtlich möglicher Interaktionen und additiver hepatotoxischer Effekte aber auch am Tag vor dem Eingriff abgesetzt und nach der Operation wieder zeitnah begonnen werden.
Hydroxychloroquin
Zur perioperativen Handhabung von Chloroquin und Hydroxychloroquin gibt es weiterhin keine ausreichenden Daten, Chloroquin wird kaum noch eingesetzt. Da diese Substanzen keine potente Immunsuppression bewirken, können sie perioperativ fortgesetzt werden. Außerdem spricht die lange Halbwertszeit von 40–50 Tagen gegen eine Unterbrechung. Eine perioperative Fortsetzung von Hydroxychloroquin wird auch in der amerikanischen Leitlinie empfohlen [4]. Bei begründeten Bedenken hinsichtlich Nebenwirkungen oder potentieller Interaktionen (z.B. QT-Intervall Verlängerungen v.a. bei höheren Dosierungen) ist aber eine kurzzeitige perioperative Unterbrechung auch aufgrund der über die HWZ hinausgehenden immunologischen Wirkung möglich, ohne dass direkt ein Krankheitsschub zu erwarten ist.
Azathioprin, Ciclosporin A, Mycophenolat
Auch bei diesen Substanzen erlaubt die aktuelle Datenlage keine evidenzbasierte Empfehlung. Diese Medikamente werden überwiegend bei Patienten mit schweren systemischen Erkrankungen wie Kollagenosen (v.a. dem systemischen Lupus erythematodes) oder bei Vaskulitiden eingesetzt. Eine potentielle immunsuppressive Auswirkung dieser Medikamenten mit möglichem Einfluss auf das Infektionsrisiko führte in den ACR Empfehlungen zur Stratifizierung von Patienten nach der Schwere der Grunderkrankung[4]: Argumentiert wurde, dass bei Patienten mit einer schweren, nicht ausreichend kontrollierten Erkrankung das Risiko einer Verschlechterung der Grunderkrankung überwiegt, weshalb die Therapie mit den genannten Substanzen fortgeführt werden sollte. Da alle Substanzen eine kurze Halbwertszeit haben (Azathioprin 4-5h, Ciclosporin A 5-10h, Mycophenolat ca 16h), sollten die Substanzen bei kurzer Pause von 1-2 Tagen vor der OP keinen unmittelbaren Effekt mehr auf die perioperative Situation haben, auch wenn die immunsuppressive Wirkung länger anhält. Die Gefahr eines Schubes der entzündlich-rheumatischen Erkrankung ist bei so kurzer Pause nicht gegeben, weshalb wir die Empfehlung beibehalten, diese Medikamente kurzfristig zu pausieren.
TNF-Inhibitoren
Im Vergleich zu den bisherigen perioperativen Empfehlungen der DGRh hat sich die Evidenzlage bezüglich des perioperativen Risikos unter Tumornekrosefaktor Inhibitoren (TNFi) nicht wesentlich verbessert. Nach wie vor existieren keine prospektiven randomisiert-kontrollierten Studien, es liegen vorwiegend Daten aus retrospektiven Kohortenstudien und wenigen retrospektiven Fall-Kontrollstudien vor. Die einzelnen Studien sind kaum miteinander vergleichbar, da sich Faktoren wie Fallzahlen, die Art der untersuchten Eingriffe, DMARD-Absetzeiten oder die Definition infektiöser Ereignisse voneinander unterscheiden. In den meisten Untersuchungen fanden Adjustierungen für relevante Kofaktoren wie Aktivität und Dauer der Grundkrankheit, vorliegende Komorbiditäten oder begleitende GC-Therapie nicht statt, vielfach sind diese Kofaktoren gar nicht dokumentiert.
Vor diesem Hintergrund sind drei Metaanalysen zum Thema bezüglich finaler Schussfolgerungen aufgrund methodischer Aspekte mit einer gewissen Zurückhaltung zu interpretieren, die in den letzten Jahren erschienen sind [24-26]. Teilweise greifen diese Metaanalysen auf die gleichen Publikationen zurück, so dass sich starke Überlappungen ergeben. Clay et al. werteten sechs Studien mit 2743 Patienten aus, verglichen wurde das Risiko für Wundinfektionen bei 1360 Patienten mit fortgeführter und 1383 mit unterbrochener TNFi-Therapie [24]. Die Absetzzeit der TNFi war ebenso wie die Art der Eingriffe unterschiedlich. Begleittherapien und Merkmale der Grunderkrankung wurden nicht erfasst, unterschiedlich war auch der untersuchte Follow-up. Zwei der Studien hatten sehr große und vier Studien kleine Fallzahlen. Die Absetzzeiten lagen bei Infliximab zwischen vier und acht, bei Adalimumab zwischen zwei und acht Wochen und bei Etanercept zwischen einer und zwei Wochen. Eine TNFi-Pause war mit einer signifikanten Risiko-Reduktion für perioperative Infektionen (RR 0.62), ebenso für generelle Komplikationen (RR 0.60) verbunden. Zwei ausgewertete Studien erfassten auch das Risiko für Schübe während der TNFi-Pause, welches signifikant um das Fünffache erhöht war (Risk Ratio 5.02).
Mabille et al. erfassten in ihrer Metaanalyse zunächst zwölf Untersuchungen für einen Vergleich des postoperativen Infektionsrisiko bei 4.975 Eingriffen unter TNFi-Therapie vs. 61.090 in einer Kontrollgruppe unter csDMARDs, fünf der Studien aus Analyse von Clay et al. waren auch hier enthalten [26]. Individuell ergaben nur 4 von 12 Studien ein signifikant höheres Risiko unter TNFi, 6 einen Trend und 2 keinen Unterschied. In der Metaanalyse war das relative Risiko unter TNFi mit 1.81 signifikant erhöht. In einer weiteren, nur 7 der Studien umfassenden Metaanalyse, wurden Unterbrechung und Fortsetzung der TNFi-Therapie verglichen und kein signifikanter Unterschied für das Infektionsrisiko ermittelt.
In einer dritten Metaanalyse werteten Goodman et al. die Ergebnisse aus 8 Beobachtungs- und 3 Fall-Kontrollstudien mit jeweils retrospektivem Charakter zusammen, wobei sich auch hier Überlappungen mit den beiden anderen Metaanalysen ergaben [25]. 3.681 Patienten mit und 4.310 ohne TNFi-Exposition im perioperativen Zeitraum wurden verglichen. Alle obengenannten Schwächen trafen auch für die meisten in dieser Publikation ausgewerteten Studien in jeweils unterschiedlichem Ausmaß zu. Die Auswertung ergab ein signifikant erhöhtes Risiko mit einer Odds Ratio von 2.47 für die TNFi-exponierten Patienten. Ein optimaler Zeitraum für das Pausieren der TNFi-Therapie konnte auch in dieser Metaanalyse wegen der Heterogenität der Ergebnisse nicht ermittelt werden.
Als Beispiel für den möglichen Nutzen einer Adjustierung für relevante Co-Faktoren vor Ermittlung des Risikos kann die japanische Studie von Kubota et al. gelten [27]. 247 Patienten mit und 300 ohne TNFi-Therapie wurden retrospektiv verglichen, es erfolgte eine Adjustierung für Alter, Krankheitsdauer, Prednisolon und Art der Eingriffe. Die unadjustierte Odds Ratio lag nicht signifikant bei 4.35, nach Adjustierung war das Infektionsrisiko unter TNFi-Therapie nicht erhöht.
Eine Reihe weiterer Studien wurden erst nach Erscheinen der Metaanalysen publiziert. In einer schwedischen Untersuchung wurden retrospektiv die Daten von 494 endoprothetischen Eingriffen ausgewertet [28]. Darunter waren 157 Patienten mit TNFi-Therapie. Es traten nur 19 Fälle (3.8%) von Wundinfektion auf, ein Bezug zur DMARD-Therapie (inkl. TNFi) fand sich nicht. Zusätzlich kam es zu 7 Fällen (1.4 %) von Prothesen-Infektionen, darunter war nur ein Fall unter laufender TNFi-Therapie.
In einer retrospektiven auf amerikanischen Versicherungsdaten beruhenden Kohortenstudie wurden 4.288 endoprothetische Eingriffe bei Patienten unter Infliximab untersucht [29]. Infektionen mit Hospitalisierung innerhalb von 30 Tagen traten in 270 Fällen (6.3 %) auf. Verglichen wurden Absetzen von Infliximab innerhalb von 4 Wochen vor dem Eingriff mit einem längeren Absetzzeitraum, es ergab sich kein Unterschied, also kein Vorteil bei längerer Absetzzeit. In einer weiteren retrospektiven Kohortenstudie der gleichen Arbeitsgruppe wurde das Risiko für Infektionen mit Hospitalisierung innerhalb von 30 Tagen, außerdem das Risiko für Protheseninfektion innerhalb eines Jahres bei 9.911 Patienten mit 10.923 Eingriffen unter diversen bDMARD-Therapien untersucht [11]. Infektionen mit Hospitalisierung traten unter den einzelnen bDMARDs in ähnlicher Häufigkeit im Bereich von 6.8 – 9.0% auf, auch bei Protheseninfektionen waren die Unterschiede gering.
Einen anderen Ansatz mit 1818 älteren Patienten unter Infliximab, die sich kardiovaskulären und intestinalen Eingriffen unterzogen, wählte eine amerikanische Arbeitsgruppe [30]. Untersucht wurden verschiedene Abstände zwischen letzter Infliximab-Gabe und Eingriff im Bereich zwischen 0 und 90 Tagen, sowie Wundinfektionen und auch andere Arten von Infektionen. Der Abstand spielte für das Auftreten von Infektionen keine Rolle.
Zusammengefasst ergibt sich ein heterogenes Bild bezüglich der gegenwärtigen Evidenzlage. Es kann nicht sicher davon ausgegangen werden, dass eine laufende TNFi-Therapie das perioperative Risiko erhöht. Aus allgemeinen Untersuchungen zum Risiko für schwere infektiöse Ereignisse unter DMARD-Therapie wissen wir, dass andere Faktoren wie z.B. Aktivität der Grunderkrankung, Komorbiditäten oder begleitende GC-Therapie das Risiko schwerwiegender Infektionen deutlich mehr beeinflussen als diese Therapie [31]. Die hier vorgestellten Untersuchungen berücksichtigen diese einflussnehmenden Faktoren jedoch kaum. Nach wie vor ist somit das tatsächliche Risiko nicht zu ermitteln.
Insbesondere lassen sich keine Belege dafür finden, dass die Länge der Absetzzeit das Infektionsrisiko bestimmt. Selbst in der aktuellsten japanische Metaanalyse von 2021 [32]wird lediglich nach bDMARD versus keine bDMARD-Therapie und nicht nach der perioperativen Unterbrechung vs. Fortführung unterschieden, so dass sich hieruns keine Empfehlungen ableiten lassen. Leider haben nur zwei Studien das Risiko für Flares bei zu langer Pause erfasst, beide ermittelten eine beträchtliche Steigerung des Risikos. Vor diesem Hintergrund scheint es nicht gerechtfertigt, weiterhin bei TNFi-Therapie vor größeren Eingriffen eine Absetzzeit von zwei Halbwertszeiten zu fordern. Wir empfehlen daher in Übereinstimmung mit den aktuellen amerikanischen Empfehlungen vor größeren Eingriffen und bei Vorhandensein sonstiger individueller Risikofaktoren eine Therapiepause von nur einem Dosierungsintervall, also eine Verkürzung der ursprünglich empfohlenen substanzbezogenen Pause von zwei Halbwertzeiten. Auch vor dem Hintergrund, dass in den vergangenen 8 Jahren mehr Erfahrungen, aber keine neue negative Evidenz hinzukam, erscheint diese Änderung gerechtfertigt.
Abatacept
Drei aktuelle Studien geben keinen Hinweis, das eine längere Pausierung von Abatacept das Risiko einer perioperativen Komplikation reduziert. Im Orencia RA Register lag bei 205 Patienten und 263 operativen Eingriffen (67% orthopädisch) die mittlere Dauer zwischen der letzten Abatacept Infusion und der OP bei 5,9 Wochen (0,3-12,0 Wochen) ohne signifikanten Unterschied bei Patienten mit bzw. ohne postoperative Komplikationen einschließlich Infektionen und Wundheilungsstörungen [33]. In einer retrospektiven Fall-Kontroll Studie aus Japan wurden Patienten mit orthopädischen Eingriffen unter Abatacept vs. csDMARDs (n=jeweils 97) hinsichtlich postoperativer Komplikationen verglichen. Im Therapievergleich und bezogen auf die Zeit der perioperativen Pausierung von Abatacept (< 6 vs. ≥ 7 Tage, < 14 vs. ≥ 14 Tage) sowie der Applikation (i.v. oder s.c.) gab es auch hier keine Unterschiede in der Komplikationsrate [34]. Mit US Abrechnungsdaten wurde der Einfluss der Zeitspanne zwischen der letzten Abatacept Gabe und einem Knie- oder Hüftgelenkersatz bei 1780 Patienten untersucht. Die Rate hospitalisierter Infektionen (9%), periprothetischer Gelenkinfektionen (2,4/100 PJ) und stationärer Wiederaufnahmen (6,3%) unterschied sich auch hier nicht signifikant bei einer kontinuierlichen Gabe (< 4 Wochen im Vergleich zur Pausierung (4–8 Wochen bzw. ≥ 8 Wochen) [35]. Diese Daten sprechen dafür, dass die Dauer der Therapiepause durchaus reduziert werden kann, ohne ein größeres Risiko in Kauf zu nehmen. Analog zu den amerikanischen Kollegen [5] empfehlen wir die OP Planung bei Abatacept am Ende des Therapieintervalls (Tab.3).
Rituximab
Für die B-Zell Depletion mit Rituximab liegt nur eine retrospektive Kohortenstudie aus dem französischen AIR Register vor [36]. Von 133 Patienten wurden 94 orthopädische und 23 abdominale Eingriffe ausgewertet. 9 Patienten hatten postoperative Komplikationen (8,5%). Die mittlere Dauer zwischen der letzten Infusion und der OP lag bei 6,4 Monaten (IQR 4,3-8,7 Monate) und unterschied sich nicht relevant zwischen Patienten mit bzw. ohne Komplikationen. Angaben über Immunglobulinspiegel gab es nicht. Bei unzureichender Datenlage empfehlen wir, elektive Eingriffe 4 Monate nach der letzten Infusion und spätestens 4 Wochen vor der nächsten Infusion zu planen. Da niedrige Immunglobulinspiegel das Infektionsrisiko erhöhen [37], könnte auch eine präoperative Bestimmung des Immunglobulinspiegels, insbesondere bei hohem Infektionsrisiko bzw. wiederkehrenden Infektionen aufgrund weiterer Risikofaktoren und der Art der OP mit Indikation zur Substitution unterhalb von 4 g/l [38,39] und Operation innerhalb von 3 Wochen nach Immunglobulin-Gabe sinnvoll sein.
Interleukin-6-Rezeptor Inhibitoren
Ähnliche Ergebnisse liefert das REGATE Register für den Interleukin (IL)-6-Rezeptor Inhibitor Tocilizumab. Hier traten bei 167 Patienten mit 165 OPs (59% orthopädisch) 15 Komplikationen, davon 10 schwerwiegend auf, aber auch hier ohne signifikante Unterschiede in der mittleren Zeitdauer (4,94 ±1,74 Wochen) zwischen der letzten Tocilizumab Infusion und dem Eingriff bei Patienten mit bzw. ohne Komplikationen [40]. Wichtig, wenn auch nicht neu, ist zu beachten, dass Tocilizumab die Warnsignale für eine postoperative Infektion (Fieber und CRP Anstieg) unterdrückt, jedoch keinen Einfluss auf die Veränderung in der Anzahl der Leukozyten hat [41]. Eine vergleichende Analyse aus US Medicare Daten zeigte keine Unterschiede in den Raten hospitalisierter Infektionen, periprothetischer Gelenkinfektionen und stationärer Wiederaufnahmen unter Abatacept, Adalimumab, Etanercept, Infliximab, Rituximab oder Tocilizumab [11]. Allerdings limitieren die niedrigeren Fallzahlen für Tocilizumab (n=389) und Rituximab (n=423) die Aussagekraft. Zu Sarilumab gibt es noch keine Daten. Bei unsicherer Datenlage bleibt die Empfehlung vorerst, Tocilizumab und Sarilumab analog zu den übrigen bDMARDs perioperativ zu pausieren.
Interleukin-1, 17, 12/23 und 23 Inhibitoren
Für die weiteren IL-Inhibitoren Anakinra, Canakinumab, Ixekizumab, Secukinumab, Guselkumab und Ustekinumab und auch für den (BLyS)-Inhibitor Belimumab gibt es noch keine Daten zum perioperativen Einsatz. Rein pragmatisch empfehlen wir, analog zu den anderen bDMARDs die geplante Operation zum Ende des jeweiligen Therapieintervalls festzusetzen (Tab.3). Da Anakinra eine sehr kurze Halbwertszeit (4-6h) hat, ist hier eine Pause 1-2 Tage vor der OP ausreichend.

Tabelle 3: Übliche Applikationsintervalle der bDMARDs
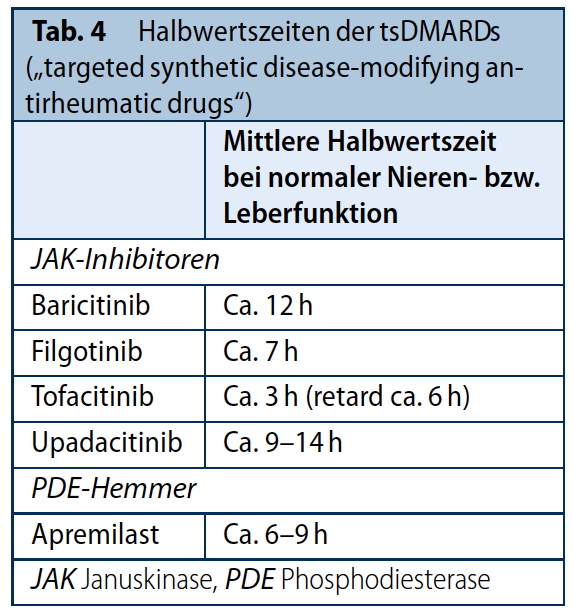
Tabelle 4: Halbwertszeiten
Targeted-synthetic DMARDs
Zu der Gruppe der tsDMARDs oder auch „small molecules“ zählen (Stand September 2021) ein Phosphodiesterase 4 (PD4) und vier Januskinase (Jak) Inhibitoren, die ein unterschiedliches Zulassungsspektrum haben. Alle 5 zugelassenen Substanzen werden oral verabreicht und haben eine kurze Halbwertszeit (s. Tab. 4), was eine gute Steuerbarkeit vor und nach Operationen bedingt und was theoretisch bezüglich des perioperativen Risikos (u.a. Wundheilung und –Infektion) von Vorteil sein könnte. Da die Substanzen aber noch relativ neu sind, ist die Evidenzlage bezüglich dieses Risikos unter tsDMARDs noch sehr eingeschränkt. Es existieren keine prospektiven randomisiert-kontrollierten Studien, es liegen lediglich wenige retrospektive Daten aus einer Fallserie, in der nur neun Patienten mit RA und einer orthopädischen OP unter Tofacitinib beschrieben wurden [42] und Daten aus der Medicare Studie [12], in der unter nicht-TNF bDMARDs bzw. tsDMARDS (n=29 Patienten mit Tofacitinib) kein erhöhtes Risiko bezüglich adjustierter 90 Tage-Mortalität und 30 Tage-Re-Hospitalisierung vorlag. In einer retrospektiven Untersuchung von 53 Patienten mit Colitis ulcerosa, die innerhalb von 4 Wochen vor einer abdominalen kolorektalen Operation Tofacitinib erhalten hatten, wurden die Raten der postoperativen Komplikationen, die innerhalb von 90 Tagen nach der Operation auftraten, ermittelt. Bei insgesamt 20 Patienten (37,7 %) traten postoperative Komplikationen auf, bei 6 Patienten (11 %) infektionsbedingte Komplikationen und bei 7 Patienten (13,2 %) eine venöse Thromboembolie (VTE) [43]. Auf Grund dieser schmalen Datenbasis konnte die ACR bei ihren recommendations von 2017 auch nur eine Empfehlung auf Grund von indirekter Evidenz einer Metaanalyse zum allgemeinen Infektionsrisiko zwischen Tofacitinib und Placebo bzw. csDMARDs heranziehen und empfahl eine Pause von sieben Tagen vor einer geplanten Operation [4]. Da Jak-Inhibitoren das Risiko für venöse Throbmoembolien erhöhen [44], erscheint eine Pausierung auch aus diesem Grund sinnvoll. Nach Auffassung der DGRh sind 3-4 Tage Pause vor der OP ausreichend. Bezüglich Apremilast empfehlen italienische Autoren eines reviews von 2018, Apremilast aufgrund der kurzen Halbwertszeit 3 Tage vor der OP zu pausieren [45]. Daten gibt es hierzu nicht. Nach Expertenmeinung der DGRh kann Apremilast perioperativ fortgeführt werden. Wenn pausiert wird, sollten alle tsDMARDs baldmöglichst bei regelrechten Wundverhältnissen wieder begonnen werden. RCT-Daten zeigen zwar, dass eine kurzzeitige Unterbrechung der Therapie mit Baricitinib (in den meisten Fällen ≤ 2 Wochen) zu keiner anhaltenden Verschlechterung der klinischen Situation führt [46], wegen der sehr kurzen HWZ sollte die Therapie aber möglichst binnen 3-5 Tagen wieder fortgesetzt werden. Unter Umständen genügen schon wenige Tage Pausierung, um einen Schub auszulösen. Daher sollte eine Pause von insgesamt 14 Tagen peri-operativ möglichst nicht überschritten werden.
Patienten mit entzündlich-rheumatischen Erkrankungen haben ein erhöhtes Risiko für postoperative Komplikationen, insbesondere für Infektionen nach einem Gelenkersatz [47,48,13]. Vor diesem Hintergrund ist der Umgang mit anti-rheumatischen Medikamenten, die möglicherweise dieses Risiko noch steigern könnten, eine wichtige Handlungsentscheidung, die bei vielen Patienten irgendwann im Verlauf ihrer Erkrankung im Raum steht. Seit Beginn der bDMARD-Therapien Anfang der 2000er sind operative Eingriffe nicht nur in Deutschland, sondern auch in vielen anderen Ländern erfreulicherweise rückläufig [49-53]. Trotzdem sind operative Eingriffe bei Patienten mit entzündlich-rheumatischen Erkrankungen weiterhin häufiger als in der Normalbevölkerung [54]. Komplikationen nach einem Eingriff scheinen hingegen rückläufig zu sein; laut Daten eines systematischen Reviews von 44 Studien zu Hüftendoprothesen halbierte sich die Komplikationsrate von 10% in den 1990ern auf 5% in den 2010ern. Dies betraf aber vor allem Revisionen und periprothetische Frakturen, während Infektionen neben aseptischen Lockerungen häufiger auftraten [55]. Die Infektionsgefahr bleibt also zentral in der Beurteilung, ob die antirheumatische Therapie perioperativ pausiert oder fortgesetzt werden sollte.
In Übereinstimmung mit den aktualisierten amerikanischen Empfehlungen [5] und aufgrund der bisherigen Datenlage empfehlen wir vor größeren Eingriffen und bei Vorhandensein sonstiger individueller Risikofaktoren für die bDMARD-Therapien eine Therapiepause von nur noch einem Dosierungsintervall. Für die csDMARD-Therapien haben wir die Dosisreduktion von Methotrexat > 20mg/Woche sowie das Ausleiten von Leflunomid bei hohem Infektionsrisiko beibehalten. Für Azathioprin, Mycophenolat und Ciclosporin A empfehlen wir weiterhin eine 1-2 tägige präoperative Pausierung. Für die Einordung und Empfehlungen bezüglich der Dauer des Pausierens anti-rheumatischer Medikamenten wurden neben der Halbwertzeit auch teilweise die anzunehmende immunologische Wirkdauer berücksichtigt. Vor allem die konventionellen DMARDs, aber auch einzelne bDMARDs (z.B. Rituximab) und JAK-Inhibitoren haben immunologische Effekte, welche über die Halbwertszeit hinausgehen können, so dass Halbwertszeiten ein Anhaltspunkt sind, aber nicht immer identischen mit dem Anhalten der immunologischen Wirkung. Für die JAK-Inhibitoren halten wir eine 3-4-tägige Pausierung bei größeren Eingriffen als ausreichend. Apremilast kann perioperativ fortgeführt werden. Bezüglich der GC empfehlen wir im Vorfeld die niedrigstmögliche Dosis einzustellen, die dann aber perioperativ stabil gehalten werden sollte.
Insgesamt mehren sich die Hinweise, dass eine Fortführung von bDMARDs in vielen Fällen möglich ist. Da es keine randomisierten Studien gibt, werden zunehmend Krankenkassendaten für diese Fragestellung ausgewertet. Diese geben Anlass zu vorsichtigem Optimismus, dass eine perioperative Fortführung der bDMARD Therapie das perioperative Infektionsrisiko nicht erhöht [56,11,35,29]. In einer schwedischen Klinik in Lund werden TNFi und die meisten anderen bDMARDs seit 2009 perioperativ routinemäßig nicht mehr unterbrochen. In der jüngsten Studie dieses Zentrums war die Infektionsrate nicht erhöht, so dass die Klinik das Fortsetzen beibehält [28]. Gerade im Hinblick auf das hohe Infektionsrisiko der GC-Therapie kann eine längere Pausierung der bDMARDs sogar ungünstig sein, vor allem, wenn dies zu einem Krankheitsschub führt, der eine höherdosierte GC-Therapie erfordert.
Eine weitere Rationale für die Fortführung der Therapie sind häufige Krankheitsschübe innerhalb von 6 Wochen nach Hüft- bzw. Kniegelenksersatz [57]. Auf der anderen Seite wurde bei postoperativen Schüben kein Einfluss auf Funktion und Schmerz nach einem Jahr beobachtet [58], daher ist zu diskutieren, ob postoperative Schübe toleriert werden können, solange die Krankheitsaktivität nicht anhaltend hoch ist. In einer kleinen Fall-Kontroll Studie, die kurz vor Fertigstellung der Empfehlungen publiziert wurde, wird eine erhöhte Wahrscheinlichkeit für periprothetische Infektionen nach Totalendoprothese unter Fortführung der Biologika-Therapie berichtet. Hier wurde bei 26 Patienten die bDMARD-Therapie fortgeführt und bei 58 Patienten pausiert [59]. Es bleiben also weitere Daten abzuwarten, um die Fragestellung der Pausierung oder Fortführung besser beantworten zu können.
Abseits der häufigsten Eingriffe an Knie- und Hüftgelenken gibt es auch Studien mit kleineren Fallzahlen, die keine erhöhte Komplikationsrate bei Eingriffen an Schulter, Fuß und Sprunggelenk sowie an der Wirbelsäule unter antirheumatischer Therapie zeigen [60-62]. Auch für handchirurgische Eingriffe gab es keine vermehrte Komplikationen bei den Patienten, bei denen die DMARD-Therapie fortgesetzt worden war, hierunter waren aber nur wenige Patienten mit bDMARDs [63]. Für Korrekturen von Deformitäten an der Wirbelsäule zeigte sich bei RA-Patienten insgesamt eine höhere Komplikationsrate vor allem bzgl. pulmonaler Thrombembolien [64] . In einer kleinen Studie mit 39 RA-Patienten, die sich einer cervikalen Arthrodese unterzogen, gab es bei Fortführung der DMARD-Therapie (n=19) keine vermehrten Komplikationen [65]. Für Wirbelsäuleneingriffe gibt es jedoch keine spezifischen Empfehlungen. Expertenmeinungen raten zum Absetzen analog zu den ACR-Empfehlungen [66].
Fazit für die Praxis
Das perioperative Infektionsrisiko ist ein multifaktorielles Geschehen, die medikamentöse Therapie aber ein wesentlicher modifizierbarer Faktor. Ob bDMARDs und auch tsDMARDs das Infektionsrisiko perioperativ erhöhen und welche Rolle die Absetzzeit dabei spielt, bleibt bei gegenwärtiger Evidenz noch unklar. Sicher ist jedoch, das GC, insbesondere in Dosierungen über 10mg/Tag das Infektionsrisiko deutlich erhöhen. Daher wurde in den aktualisierten Empfehlungen der DGRh die perioperative Pausierung von bDMARDs von mindestens zwei Halbwertszeiten auf ein Therapieintervall reduziert, um das Risiko eines Krankheitsschubs unter längerer Therapiepause zu minimieren. Die neueren „small molecules“ wie Jak-Inhibitoren sollten auf Grund der sehr kurzen Halbwertszeiten peri-operativ nicht zu lange pausiert werden, um Schübe der Erkrankung nicht zu riskieren.
Einhaltung ethischer Richtlinien
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Interessenkonflikt. Die Autoren geben an, dass keine Interessenkonflikte bestehen.
Korrespondenzadresse
Prof. Dr. Klaus Krüger
Rheumatologisches Praxiszentrum
St.-Bonifatius-Str. 5, 81541 München
Klaus.Krueger@med.uni-muenchen.de
1. Callhoff J, Thiele K, Henes J, Richter J, Aringer M, Zink A, Albrecht K (2018) Deutlicher Rückgang von Gelenkoperationen bei Patienten mit rheumatoider Arthritis: Ergebnisse der Kerndokumentation 1996-2016. DGRh, Mannheim, 19 -22 September 2018, German Medical Science GMS Publishing House, Düsseldorf, doi 10.3205/18dgrh057
2. Krüger K, Albrecht K, Rehart S, Scholz R, Kommission Pharmakotherapie der D (2014) Empfehlungen der Deutschen Gesellschaft für Rheumatologie zur perioperativen Vorgehensweise unter Therapie mit DMARD und Biologicals bei entzündlich-rheumatischen Erkrankungen. Z Rheumatol 73 (1):77-84. doi:10.1007/s00393-013-1301-z
3. Krüger K (2017) Perioperatives Management bei Gelenkeingriffen unter immunsuppressiver Therapie. Z Rheumatol 76 (9):767-775. doi:10.1007/s00393-017-0379-0
4. Goodman SM, Springer B, Guyatt G, et al. (2017) 2017 American College of Rheumatology/American Association of Hip and Knee Surgeons Guideline for the Perioperative Management of Antirheumatic Medication in Patients With Rheumatic Diseases Undergoing Elective Total Hip or Total Knee Arthroplasty. Arthritis Rheumatol 69 (8):1538-1551. doi:10.1002/art.40149
5. Goodman SM, George MD (2020) 'Should we stop or continue conventional synthetic (including glucocorticoids) and targeted DMARDs before surgery in patients with inflammatory rheumatic diseases?'. RMD Open 6 (2). doi:10.1136/rmdopen-2020-001214
6. Premkumar A, Morse K, Levack AE, Bostrom MP, Carli AV (2018) Periprosthetic Joint Infection in Patients with Inflammatory Joint Disease: Prevention and Diagnosis. Curr Rheumatol Rep 20 (11):68. doi:10.1007/s11926-018-0777-6
7. Rehart S, Wickler B, Henniger M (2020) Perioperatives Management bei der Traumaversorgung von „Rheumatikern“ unter Immunsuppression. Unfallchirurg 123 (8):588-596. doi:10.1007/s00113-020-00826-2
8. Chalmers BP, Weston JT, Osmon DR, Hanssen AD, Berry DJ, Abdel MP (2019) Prior hip or knee prosthetic joint infection in another joint increases risk three-fold of prosthetic joint infection after primary total knee arthroplasty: a matched control study. Bone Joint J 101-B (7_Supple_C):91-97. doi:10.1302/0301-620X.101B7.BJJ-2018-1189.R1
9. Schiegnitz EA, Hoefert S, Otto S, al. e (2018) S3-Leitlinie Antiresorptiva-assoziierte Kiefernekrosen (AR-ONJ). https://www.awmf.org/uploads/tx_szleitlinien/007-091l_S3_Antiresorptiva-assoziierte-Kiefernekrosen-AR-ONJ_2018-12.pdf, 2018.
10. Hoefert S (2019) Medikamenten-assoziierte Kiefernekrosen – Relevanz aus rheumatologischer Sicht? Arthritis und Rheuma 39: 385 - 390 DOI: 10.1055/a-1037-0874
11. George MD, Baker JF, Winthrop K, Curtis JR (2019) Risk of Biologics and Glucocorticoids in Patients With Rheumatoid Arthritis Undergoing Arthroplasty. Ann Intern Med 171 (9):680. doi:10.7326/L19-0528
12. George MD, Baker JF, Winthrop KL, et al. (2020) Immunosuppression and the risk of readmission and mortality in patients with rheumatoid arthritis undergoing hip fracture, abdominopelvic and cardiac surgery. Ann Rheum Dis 79 (5):573-580. doi:10.1136/annrheumdis-2019-216802
13. Cordtz RL, Zobbe K, Hojgaard P, e (2018) Predictors of revision, prosthetic joint infection and mortality following total hip or total knee arthroplasty in patients with rheumatoid arthritis: a nationwide cohort study using Danish healthcare registers. Ann Rheum Dis 77 (2):281-288. doi:10.1136/annrheumdis-2017-212339
14. Kittle H, Ormseth A, Patetta MJ, Sood A, Gonzalez MH (2020) Chronic Corticosteroid Use as a Risk Factor for Perioperative Complications in Patients Undergoing Total Joint Arthroplasty. J Am Acad Orthop Surg Glob Res Rev 4 (7):e2000001. doi:10.5435/JAAOSGlobal-D-20-00001
15. Somayaji R, Barnabe C, Martin L (2013) Risk factors for infection following total joint arthroplasty in rheumatoid arthritis. Open Rheumatol J 7:119-124. doi:10.2174/1874312920131210005
16. Au K, Reed G, Curtis JR, Kremer JM, Greenberg JD, Strand V, Furst DE, Investigators C (2011) High disease activity is associated with an increased risk of infection in patients with rheumatoid arthritis. Ann Rheum Dis 70 (5):785-791. doi:10.1136/ard.2010.128637
17. Marik PE, Varon J (2008) Requirement of perioperative stress doses of corticosteroids: a systematic review of the literature. Arch Surg 143 (12):1222-1226. doi:10.1001/archsurg.143.12.1222
18. Grennan DM, Gray J, Loudon J, Fear S (2001) Methotrexate and early postoperative complications in patients with rheumatoid arthritis undergoing elective orthopaedic surgery. Ann Rheum Dis 60 (3):214-217. doi:10.1136/ard.60.3.214
19. Sany J, Anaya JM, Canovas F, Combe B, Jorgensen C, Saker S, Thaury MN, Gavroy JP (1993) Influence of methotrexate on the frequency of postoperative infectious complications in patients with rheumatoid arthritis. J Rheumatol 20 (7):1129-1132
20. Afzali A, Park CJ, Zhu K, Hu JK, Sharma P, Sinanan MN, Lee SD (2016) Preoperative Use of Methotrexate and the Risk of Early Postoperative Complications in Patients with Inflammatory Bowel Disease. Inflamm Bowel Dis 22 (8):1887-1895. doi:10.1097/MIB.0000000000000780
21. Tanaka N, Sakahashi H, Sato E, Hirose K, Ishima T, Ishii S (2003) Examination of the risk of continuous leflunomide treatment on the incidence of infectious complications after joint arthroplasty in patients with rheumatoid arthritis. J Clin Rheumatol 9 (2):115-118. doi:10.1097/01.RHU.0000062514.54375.bd
22. Fuerst M, Mohl H, Baumgartel K, Ruther W (2006) Leflunomide increases the risk of early healing complications in patients with rheumatoid arthritis undergoing elective orthopedic surgery. Rheumatol Int 26 (12):1138-1142. doi:10.1007/s00296-006-0138-z
23. den Broeder AA, Creemers MC, Fransen J, de Jong E, de Rooij DJ, Wymenga A, de Waal-Malefijt M, van den Hoogen FH (2007) Risk factors for surgical site infections and other complications in elective surgery in patients with rheumatoid arthritis with special attention for anti-tumor necrosis factor: a large retrospective study. J Rheumatol 34 (4):689-695
24. Clay M, Mazouyes A, Gilson M, Gaudin P, Baillet A (2016) Risk of postoperative infections and the discontinuation of TNF inhibitors in patients with rheumatoid arthritis: A meta-analysis. Joint Bone Spine 83 (6):701-705. doi:10.1016/j.jbspin.2015.10.019
25. Goodman SM, Menon I, Christos PJ, Smethurst R, Bykerk VP (2016) Management of perioperative tumour necrosis factor alpha inhibitors in rheumatoid arthritis patients undergoing arthroplasty: a systematic review and meta-analysis. Rheumatology (Oxford) 55 (3):573-582. doi:10.1093/rheumatology/kev364
26. Mabille C, Degboe Y, Constantin A, Barnetche T, Cantagrel A, Ruyssen-Witrand A (2017) Infectious risk associated to orthopaedic surgery for rheumatoid arthritis patients treated by anti-TNFalpha. Joint Bone Spine 84 (4):441-445. doi:10.1016/j.jbspin.2016.06.011
27. Kubota A, Sekiguchi M, Nakamura T, Miyazaki Y, Suguro T (2014) Does use of a biologic agent increase the incidence of postoperative infection in surgery for rheumatoid arthritis after total joint arthroplasty? Mod Rheumatol 24 (3):430-433. doi:10.3109/14397595.2013.844387
28. Borgas Y, Gulfe A, Kindt M, Stefansdottir A (2020) Anti-rheumatic treatment and prosthetic joint infection: an observational study in 494 elective hip and knee arthroplasties. BMC Musculoskelet Disord 21 (1):410. doi:10.1186/s12891-020-03459-z
29. George MD, Baker JF, Hsu JY, Wu Q, Xie F, Chen L, Yun H, Curtis JR (2017) Perioperative Timing of Infliximab and the Risk of Serious Infection After Elective Hip and Knee Arthroplasty. Arthritis Care Res (Hoboken) 69 (12):1845-1854. doi:10.1002/acr.23209
30. Ward MM, Dasgupta A (2020) Pre-operative withholding of infliximab and the risk of infections after major surgery in patients with rheumatoid arthritis. Rheumatology (Oxford) 59 (12):3917-3926. doi:10.1093/rheumatology/keaa291
31. Strangfeld A, Eveslage M, Schneider M, Bergerhausen HJ, Klopsch T, Zink A, Listing J (2011) Treatment benefit or survival of the fittest: what drives the time-dependent decrease in serious infection rates under TNF inhibition and what does this imply for the individual patient? Ann Rheum Dis 70 (11):1914-1920. doi:10.1136/ard.2011.151043
32. Ito H, Murata K, Sobue Y, Kojima T, Nishida K, Matsushita I, Kawahito Y, Kojima M, Hirata S, Kaneko Y, Kishimoto M, Kohno M, Mori M, Morinobu A, Murashima A, Seto Y, Sugihara T, Tanaka E, Nakayama T, Harigai M (2021) Comprehensive risk analysis of postoperative complications in patients with rheumatoid arthritis for the 2020 update of the Japan College of Rheumatology clinical practice guidelines for the management of rheumatoid arthritis. Mod Rheumatol:1-11. doi:10.1080/14397595.2021.1913824
33. Latourte A, Gottenberg JE, Luxembourger C, Pane I, Claudepierre P, Richette P, Lafforgue P, Combe B, Cantagrel A, Sibilia J, Flipo RM, Gaudin P, Vittecoq O, Schaeverbeke T, Dougados M, Sellam J, Ravaud P, Mariette X, Seror R (2017) Safety of surgery in patients with rheumatoid arthritis treated by abatacept: data from the French Orencia in Rheumatoid Arthritis Registry. Rheumatology (Oxford) 56 (4):629-637. doi:10.1093/rheumatology/kew476
34. Ito H, Tsuji S, Nakayama M, Mochida Y, Nishida K, Ishikawa H, Kojima T, Matsumoto T, Kubota A, Mochizuki T, Sakuraba K, Matsushita I, Nakajima A, Hara R, Haraguchi A, Matsubara T, Kanbe K, Nakagawa N, Hamaguchi M, Momohara S, Consortium J (2020) Does Abatacept Increase Postoperative Adverse Events in Rheumatoid Arthritis Compared with Conventional Synthetic Disease-modifying Drugs? J Rheumatol 47 (4):502-509. doi:10.3899/jrheum.181100
35. George MD, Baker JF, Winthrop K, Alemao E, Chen L, Connolly S, Hsu JY, Simon TA, Wu Q, Xie F, Yang S, Curtis JR (2019) Timing of Abatacept Before Elective Arthroplasty and Risk of Postoperative Outcomes. Arthritis Care Res (Hoboken) 71 (9):1224-1233. doi:10.1002/acr.23843
36. Godot S, Gottenberg JE, Paternotte S, Pane I, Combe B, Sibilia J, Flipo RM, Schaeverbeke T, Ravaud P, Toussirot E, Berenbaum F, Mariette X, Wendling D, Sellam J (2013) Safety of surgery after rituximab therapy in 133 patients with rheumatoid arthritis: data from the autoimmunity and rituximab registry. Arthritis Care Res (Hoboken) 65 (11):1874-1879. doi:10.1002/acr.22056
37. Md Yusof MY, Vital EM, McElvenny DM, Hensor EMA, Das S, Dass S, Rawstron AC, Buch MH, Emery P, Savic S (2019) Predicting Severe Infection and Effects of Hypogammaglobulinemia During Therapy With Rituximab in Rheumatic and Musculoskeletal Diseases. Arthritis Rheumatol 71 (11):1812-1823. doi:10.1002/art.40937
38. Kneitz C, Krüger K (2021) Infektionsprophylaxe bei rheumatologischen Erkrankungen. Z Rheumatol 80 (2):149-157. doi:10.1007/s00393-020-00938-5
39. Hanitsch L, Baumann U, Boztug K, al. e S3-Leitlinie 18-001: Therapie primärer Antikörpermangelerkrankungen04/2019 www.awmf.org/uploads/tx_szleitlinien/189-001l
40. Morel J, Locci M, Banal F, Combe B, Cormier G, Dougados M, Flipo RM, Marcelli C, Pham T, Rist S, Solau Gervais E, Sibilia J, Lukas C (2020) Safety of surgery in patients with rheumatoid arthritis treated with tocilizumab: data from the French (REGistry -RoAcTEmra) Regate registry. Clin Exp Rheumatol 38 (3):405-410
41. Hirao M, Hashimoto J, Tsuboi H, Nampei A, Nakahara H, Yoshio N, Mima T, Yoshikawa H, Nishimoto N (2009) Laboratory and febrile features after joint surgery in patients with rheumatoid arthritis treated with tocilizumab. Ann Rheum Dis 68 (5):654-657. doi:10.1136/ard.2008.090068
42. Nishida K, Harada R, Nasu Y, Takeshita A, Nakahara R, Natsumeda M, Ozaki T (2018) The clinical course of patients with rheumatoid arthritis who underwent orthopaedic surgeries under disease control by tofacitinib. Mod Rheumatol 28 (6):1063-1065. doi:10.1080/14397595.2018.1427431
43. Lightner AL, Vaidya P, Holubar S, Warusavitarne J, Sahnan K, Carrano FM, Spinelli A, Zaghiyan K, Fleshner PR (2021) Perioperative safety of tofacitinib in surgical ulcerative colitis patients. Colorectal Dis 23 (8):2085-2090. doi:10.1111/codi.15702
44. Ketfi C, Boutigny A, Mohamedi N, Bouajil S, Magnan B, Amah G, Dillinger JG (2021) Risk of venous thromboembolism in rheumatoid arthritis. Joint Bone Spine 88 (3):105122. doi:10.1016/j.jbspin.2020.105122
45. Gualtierotti R, Parisi M, Ingegnoli F (2018) Perioperative Management of Patients with Inflammatory Rheumatic Diseases Undergoing Major Orthopaedic Surgery: A Practical Overview. Adv Ther 35 (4):439-456. doi:10.1007/s12325-018-0686-0
46. Emery P, Tanaka Y, Cardillo T, Schlichting D, Rooney T, Beattie S, Helt C, Smolen JS (2020) Temporary interruption of baricitinib: characterization of interruptions and effect on clinical outcomes in patients with rheumatoid arthritis. Arthritis Res Ther 22 (1):115. doi:10.1186/s13075-020-02199-8
47. Cordtz R, Odgaard A, Kristensen LE, Overgaard S, Dreyer L (2020) Risk of medical complications following total hip or knee arthroplasty in patients with rheumatoid arthritis: A register-based cohort study from Denmark. Semin Arthritis Rheum 50 (1):30-35. doi:10.1016/j.semarthrit.2019.06.007
48. Richardson SS, Kahlenberg CA, Goodman SM, Russell LA, Sculco TP, Sculco PK, Figgie MP (2019) Inflammatory Arthritis Is a Risk Factor for Multiple Complications After Total Hip Arthroplasty: A Population-Based Comparative Study of 68,348 Patients. J Arthroplasty 34 (6):1150-1154 e1152. doi:10.1016/j.arth.2019.02.018
49. Nystad TW, Fenstad AM, Furnes O, Havelin LI, Skredderstuen AK, Fevang BT (2016) Reduction in orthopaedic surgery in patients with rheumatoid arthritis: a Norwegian register-based study. Scand J Rheumatol 45 (1):1-7. doi:10.3109/03009742.2015.1050451
50. Gogna R, Cheung G, Arundell M, Deighton C, Lindau TR (2015) Rheumatoid hand surgery: is there a decline? A 22-year population-based study. Hand (N Y) 10 (2):272-278. doi:10.1007/s11552-014-9708-9
51. Cordtz R, Hawley S, Prieto-Alhambra D, Hojgaard P, Zobbe K, Kristensen LE, Overgaard S, Odgaard A, Soussi BG, Dreyer L (2020) Reduction in Upper Limb Joint Surgery Among Rheumatoid Arthritis Patients: An Interrupted Time-Series Analysis Using Danish Health Care Registers. Arthritis Care Res (Hoboken) 72 (2):274-282. doi:10.1002/acr.23835
52. Cordtz RL, Hawley S, Prieto-Alhambra D, Hojgaard P, Zobbe K, Overgaard S, Odgaard A, Kristensen LE, Dreyer L (2018) Incidence of hip and knee replacement in patients with rheumatoid arthritis following the introduction of biological DMARDs: an interrupted time-series analysis using nationwide Danish healthcare registers. Ann Rheum Dis 77 (5):684-689. doi:10.1136/annrheumdis-2017-212424
53. Matsumoto T, Nishino J, Izawa N, Naito M, Hirose J, Tanaka S, Yasui T, Saisho K, Tohma S (2017) Trends in Treatment, Outcomes, and Incidence of Orthopedic Surgery in Patients with Rheumatoid Arthritis: An Observational Cohort Study Using the Japanese National Database of Rheumatic Diseases. J Rheumatol 44 (11):1575-1582. doi:10.3899/jrheum.170046
54. Guldberg-Moller J, Cordtz RL, Kristensen LE, Dreyer L (2019) Incidence and time trends of joint surgery in patients with psoriatic arthritis: a register-based time series and cohort study from Denmark. Ann Rheum Dis 78 (11):1517-1523. doi:10.1136/annrheumdis-2019-215313
55. Taylor-Williams O, Nossent J, Inderjeeth CA (2020) Incidence and Complication Rates for Total Hip Arthroplasty in Rheumatoid Arthritis: A Systematic Review and Meta-Analysis Across Four Decades. Rheumatol Ther. doi:10.1007/s40744-020-00238-z
56. Abou Zahr Z, Spiegelman A, Cantu M, Ng B (2015) Perioperative use of anti-rheumatic agents does not increase early postoperative infection risks: a Veteran Affairs' administrative database study. Rheumatol Int 35 (2):265-272. doi:10.1007/s00296-014-3121-0
57. Goodman SM, Bykerk VP, DiCarlo E, Cummings RW, Donlin LT, Orange DE, Hoang A, Mirza S, McNamara M, Andersen K, Bartlett SJ, Szymonifka J, Figgie MP (2018) Flares in Patients with Rheumatoid Arthritis after Total Hip and Total Knee Arthroplasty: Rates, Characteristics, and Risk Factors. J Rheumatol 45 (5):604-611. doi:10.3899/jrheum.170366
58. Goodman SM, Mirza SZ, DiCarlo EF, Pearce-Fisher D, Zhang M, Mehta B, Donlin LT, Bykerk VP, Figgie MP, Orange DE (2020) Rheumatoid Arthritis Flares After Total Hip and Total Knee Arthroplasty: Outcomes at One Year. Arthritis Care Res (Hoboken) 72 (7):925-932. doi:10.1002/acr.24091
59. Carlson VR, Anderson LA, Lu CC, Sauer BC, Blackburn BE, Gililland JM (2021) Perioperative Continuation of Biologic Medications Increases Odds of Periprosthetic Joint Infection in Patients With Inflammatory Arthropathy. J Arthroplasty 36 (7):2546-2550. doi:10.1016/j.arth.2021.02.025
60. Mangold DR, Wagner ER, Cofield RH, Sanchez-Sotelo J, Sperling JW (2019) Reverse shoulder arthroplasty for rheumatoid arthritis since the introduction of disease-modifying drugs. Int Orthop 43 (11):2593-2600. doi:10.1007/s00264-019-04373-3
61. Dougherty CD, Hung YY, Weintraub MLR, Patel S, King CM (2019) Osseous and Soft Tissue Complications Associated With Foot and Ankle Surgery in Patients With Rheumatoid Arthritis Taking a Variety of Antirheumatic Medications. J Foot Ankle Surg 58 (3):508-513. doi:10.1053/j.jfas.2018.09.030
62. Koyama K, Ohba T, Ebata S, Haro H (2016) Postoperative Surgical Infection After Spinal Surgery in Rheumatoid Arthritis. Orthopedics 39 (3):e430-433. doi:10.3928/01477447-20160404-05
63. Klifto KM, Cho BH, Lifchez SD (2020) The Management of Perioperative Immunosuppressant Medications for Rheumatoid Arthritis During Elective Hand Surgery. J Hand Surg Am 45 (8):779 e771-779 e776. doi:10.1016/j.jhsa.2020.02.005
64. Dalle Ore CL, Ames CP, Deviren V, Lau D (2019) Perioperative outcomes associated with thoracolumbar 3-column osteotomies for adult spinal deformity patients with rheumatoid arthritis. J Neurosurg Spine 30 (6):822-832. doi:10.3171/2018.11.SPINE18927
65. Elia CJ, Brazdzionis J, Toor H, Takayanagi A, Hariri O, Asgarzadie F, Rao S, Guppy K, Tashjian V (2020) Impact of Chronic DMARD Therapy in Patients With Rheumatoid Arthritis Undergoing Surgery of the Craniovertebral Junction: A Multi-center Retrospective Study. Spine (Phila Pa 1976) 45 (13):930-936. doi:10.1097/BRS.0000000000003402
66. Joo P, Ge L, Mesfin A (2020) Surgical Management of the Lumbar Spine in Rheumatoid Arthritis. Global Spine J 10 (6):767-774. doi:10.1177/2192568219886267
